近日,美国加州大学戴维斯分校直博毕业生、目前在美国斯坦福大学从事博士后研究的董春阳,联合开发一款新型基因编码荧光探针,为神经肽动力学研究提供了创新工具。
 图 | 董春阳(来源:董春阳)
图 | 董春阳(来源:董春阳)
据介绍,本次研究的核心思想在于:将荧光蛋白与阿片受体融合,通过受体构象变化引起的荧光信号变化,来实时地反映阿片肽的结合过程。
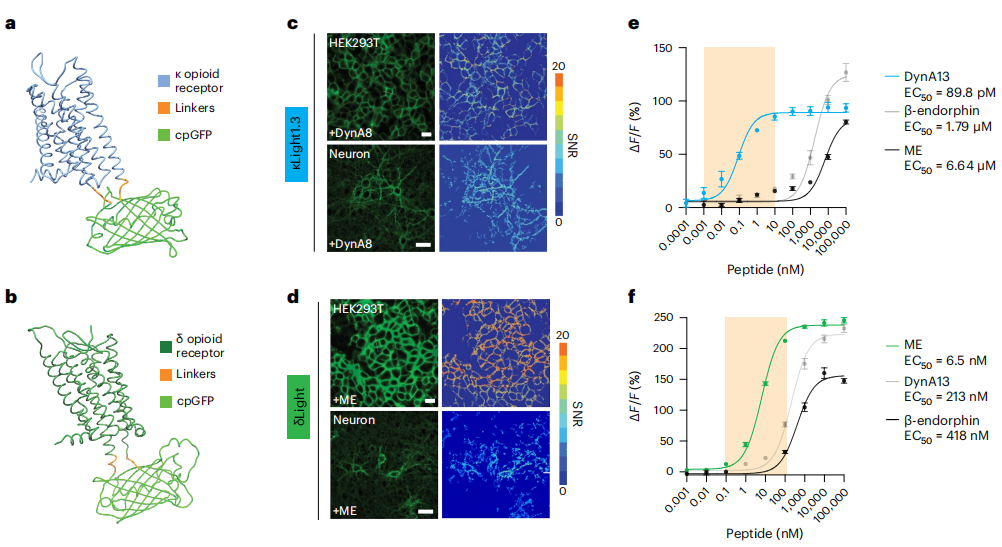
期间,董春阳等人针对三种主要的阿片受体亚型——κ 受体、δ 受体和 μ 受体,分别设计了相应的荧光探针 κLight、δLight 和 μLight。
这样一来,不仅可以区分不同类型的阿片肽,还能在单个细胞水平上实现高时空分辨率的信号检测。
 (来源:Nature Neuroscience)
(来源:Nature Neuroscience)
通过开发和应用新型荧光探针,本次研究旨在从多个层面,深入探索阿片肽系统的功能和调控机制。
这不仅能帮助人们理解阿片系统在情感行为和动机行为中的作用,还可能为理解和治疗相关精神疾病提供新见解。
通过研究分子水平的受体-配体相互作用、研究细胞水平和回路水平的信号传递、以及研究整体行为水平的功能调控,本次成果有望为阿片系统的研究带来革命性进展。
它让人们朝着更好地理解内源性阿片系统迈出了重要一步,为阿片肽系统的研究提供了富有价值的新工具。
对于当前的神经科学“工具箱”来说,内源性阿片类物质和合成阿片类物质的探针是一个很好的补充,能为阿片类信号传导带来更好的时空采样。
这既能推动神经科学基础研究的发展,也有望为疼痛管理、成瘾治疗等临床应用开辟新前景。
 (来源:Nature Neuroscience)
(来源:Nature Neuroscience)
 从阿片类神经肽的“地位”说起
从阿片类神经肽的“地位”说起
据介绍,在神经科学领域,阿片类神经肽系统占据着核心地位。
而作为一类关键的神经调节物质,阿片肽在调控疼痛感知、奖赏行为、情绪反应、以及成瘾过程等多个生理过程和病理过程中,扮演着不可或缺的角色。
然而,长期以来对于内源性阿片肽系统的深入研究,一直受到技术手段的限制。
免疫组化、放射性配体结合实验等传统研究方法,虽然能够提供静态的阿片肽分布信息,但是难以捕捉到阿片肽在活体神经系统中的动态释放过程和精细的时空分布模式。
特别是在探究特定神经回路中的阿片肽功能,以及探究在复杂行为状态下阿片肽释放的动态变化时,现有技术往往显得力不从心。
为了突破上述瓶颈,董春阳和合作者基于基因编码开发出这种阿片受体荧光探针策略。
此前,董春阳的博士导师曾开发一种钙离子探针 GCaMP3,该探针能在多物种体内使用荧光来解析脑神经活性,为高时空分辨率检测神经活性做出了重要贡献。
也为钙离子探针的优化奠定了一定基础,目前 GCaMP 系列钙离子探针已在神经科学领域得到广泛应用。
董春阳导师的上述成果,为本次开发新型神经递质探针奠定了基础。
在导师的指导之下,这几年来董春阳曾参与研究红移的多巴胺探针,并开发出两种 5-羟色胺探针、以及其他多种神经肽探针。
同时,董春阳还与北京大学李毓龙教授团队合作发表了关于神经递质探针开发和应用的综述论文。这些经验为他探索更加复杂的阿片肽探针提供了一定洞见。
在此基础之上,董春阳意识到与之前开发的神经递质探针相比,阿片肽探针的开发面临着更大的挑战。
阿片肽系统非常复杂,其包括多种内源性阿片肽和多个受体亚型,这让开发具有高度特异性的探针变得尤为困难。
而且与其他探针不同的是,阿片肽探针的开发没有现成的公式可循。这意味着每一个探针变体都需要单独设计和逐一验证,这大大增加了工作量和复杂性。
比如,需要在保持受体功能的同时,找到最佳的荧光蛋白插入位点和连接序列。期间,涉及到大量的分子生物学工作,包括设计、构建和筛选数百个不同的变体。
而在体外表征阶段,则需要仔细评估每个探针变体对不同阿片肽和受体亚型的反应。包括详细测定探针的动态范围、灵敏度、选择性以及反应动力学。
通过大量的体外表征实验,董春阳等人筛选出了动态范围较大、灵敏度较高、特异性较高的变体。
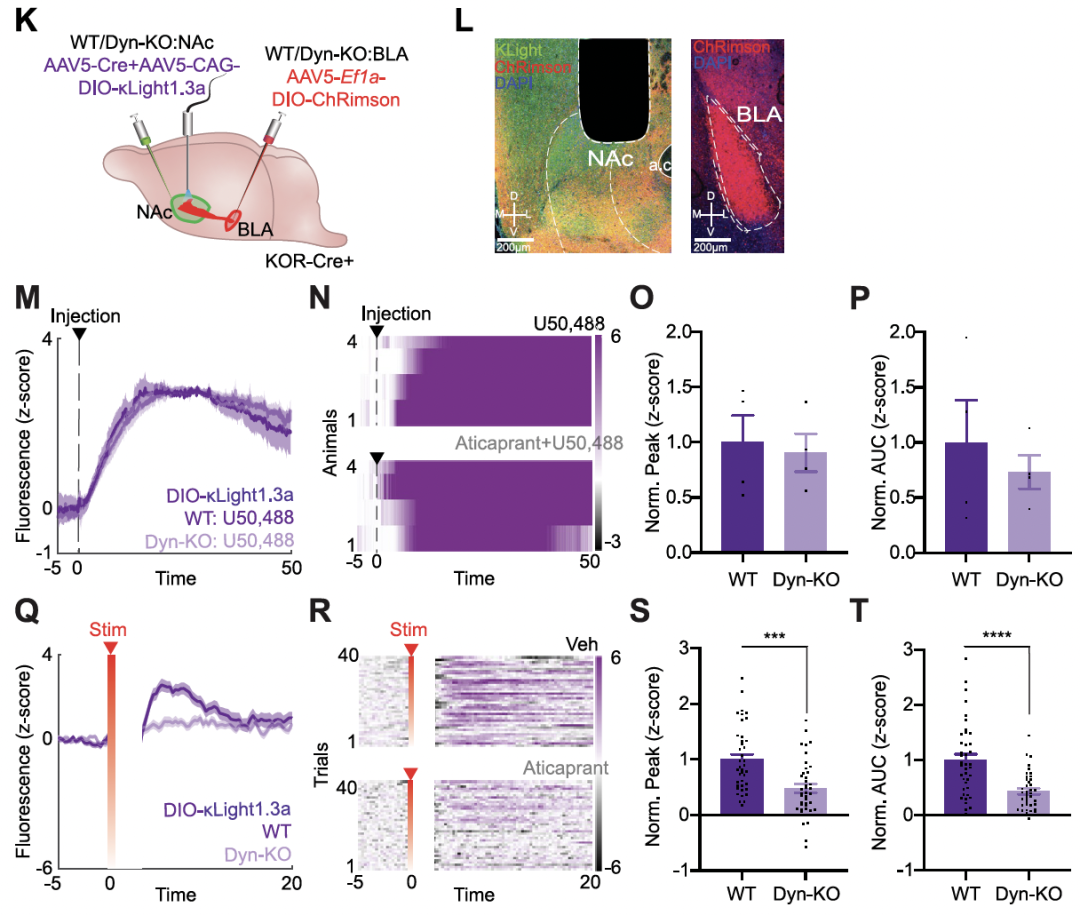
随后,他们围绕探针的特异性开展验证工作,并在强啡肽敲除小鼠和野生型小鼠之间,利用光遗传刺激 BLA-NAc 回路的实验,证明了 κLight 对于强啡肽的特异性。
这不仅能确保探针在复杂神经环境中仍能保持特异性和灵敏度,也确保了用户在生理条件下使用探针的可靠性。
 (来源:Nature Neuroscience)
(来源:Nature Neuroscience)
 无数次的重复、失败、优化、再重复
无数次的重复、失败、优化、再重复
董春阳表示,本次研究的目标之一,是希望在体外和离体脑片中,全面表征这些新型探针的药理学特性。
包括测定探针对于不同内源性阿片肽和合成阿片肽的亲和力、选择性和动力学特征。
在与传统放射性配体结合实验加以对比之后,他们希望验证这些探针能否准确地反映阿片肽与受体的相互作用。
同时,还需要评估探针的表达,是否会影响内源性阿片受体的正常功能,以便确保其在生理条件下的应用价值。
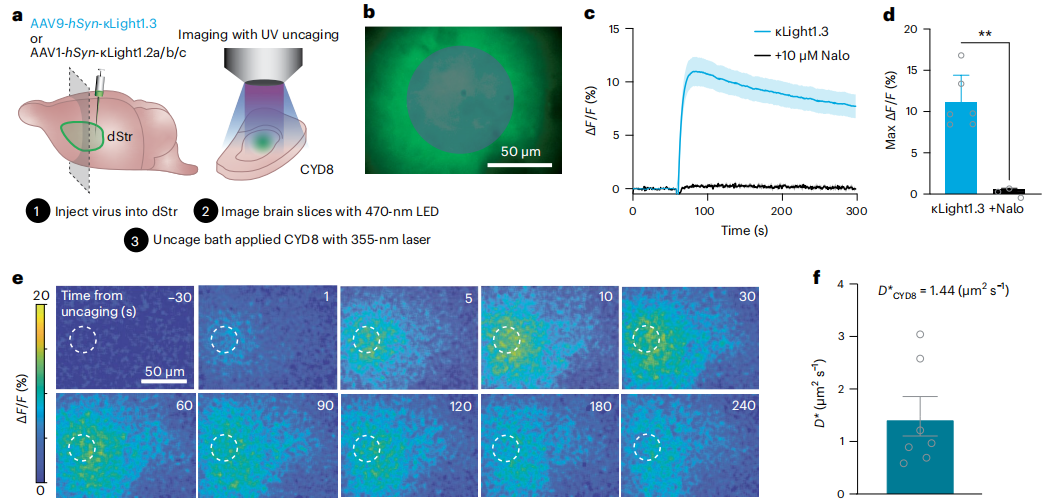
本次研究的目标之二,是希望利用这些探针探索阿片肽在脑组织中的扩散特性。
此前,人们认为阿片肽主要通过体积传递的方式来发挥作用。但是,对于具体的扩散范围和速率,始终缺乏直接的证据。
为此,该课题组设计了精巧的光解实验,通过释放光敏性阿片肽前体,来同时监测荧光信号的变化,借此首次实现了对于阿片肽扩散过程的实时观察和定量分析。
通过这一实验,他们不仅揭示了阿片肽的扩散常数,还为理解阿片肽信号的空间范围提供了重要依据。
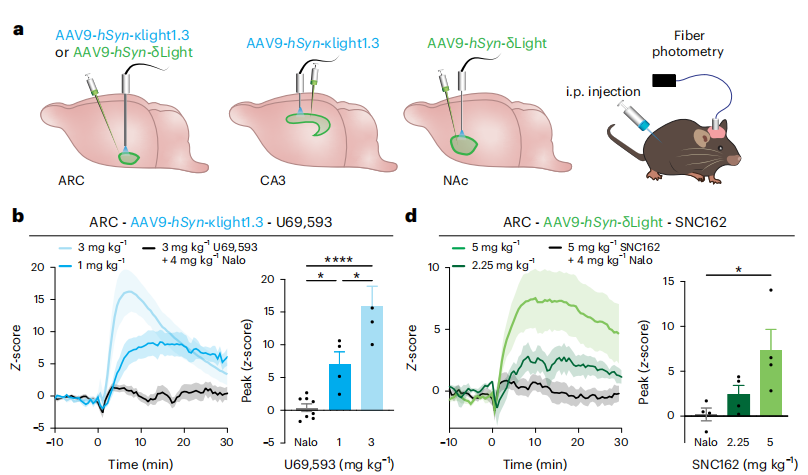
本次研究的目标之三,是希望确定能够触发内源性阿片肽释放的最佳电刺激参数,这对于在体内研究阿片肽的功能至关重要。
通过在脑片中系统地调整刺激强度、刺激频率和刺激持续时间,以及监测荧光探针的响应,该团队希望找出最有效的刺激模式,从而为电生理实验和光遗传学实验奠定一定基础。
在活体动物实验中,他们将这些荧光探针与光遗传学技术加以结合,借此探索特定神经回路中的阿片肽释放动态。
例如,通过在伏隔核表达 κLight 探针,以及在杏仁核表达光敏性离子通道,就能精确地控制特定投射的激活,并能实时观察由此诱发的内源性强啡肽释放。
这种做法的好处在于:不仅能提供前所未有的时间和空间分辨率,还能揭示阿片肽释放的空间特异性。
此外,课题组还开展了如下探索:即在复杂行为状态之下比如在恐惧条件化过程和奖赏学习过程中,探索阿片肽释放会发生的动态变化。
通过在自由活动的动物中开展光纤光度测量,董春阳等人用探针捕捉到了与特定行为相关的阿片肽信号变化。
他至今记得首次在活体小鼠中成功捕捉到内源性阿片肽释放的瞬间。其表示:“我们花了几年时间来优化探针,终于在体外确认了一个预期能在活体中成功应用的变体。”
详细来说,他们将 κLight 质粒包裹到腺相关病毒之中,在熟悉小鼠脑区坐标之后,开始进行颅内病毒注射,然后等待探针在小鼠脑子里表达。
“无数次的重复、失败、优化、再重复,当在光线记录的电脑屏幕上看到了 κLight 探针随着恐惧条件刺激的进行,一个又一个明亮的信号峰开始出现,让人确实有点感动。”董春阳说。
但是,科学的理性很快把他拽回来,他必须证明自己看到的是 κLight 检测到强啡肽的信号而不是其他假象。
通过多只小鼠证明上述现象的可重复性之后,课题组通过设计不同实验,尤其是使用强啡肽敲除小鼠的光遗传实验,证明在没有强啡肽且刺激相同的情况下,探针不会出现信号,借此证明了探针的准确性和特异性。
最后,当各个实验都指向一个特异性强且信噪比高的结果时,大家悬着的心才终于放下。
 (来源:Nature Neuroscience)
(来源:Nature Neuroscience)
最终,相关论文以《利用基因编码生物探针揭示阿片类神经肽动态》(Unlocking opioid neuropeptide dynamics with genetically encoded biosensors)为题发在 Nature Neuroscience(IF 21.2)。
 图 | 相关论文(来源:Nature Neuroscience)
图 | 相关论文(来源:Nature Neuroscience)
董春阳和美国华盛顿大学拉贾拉姆·高里尚卡尔 (Raajaram Gowrishankar)是共同一作。
美国华盛顿大学迈克尔·布鲁查斯(Michael R. Bruchas)教授、美国加州大学圣地亚哥分校马修·班哈特(Matthew R. Banghart)教授、以及马克斯普朗克佛罗里达州神经科学研究所田琳教授担任共同通讯作者。
凭借这一成果,董春阳获得了美国国立卫生院托妮·希彭伯格 (Toni Shippenberg)青年研究者奖。
在应用前景上:
其一,能用于基础神经科学研究。
本次打造的阿片受体荧光探针,将让人们更精确地观察和测量阿片肽在神经系统中的动态变化,从而帮助揭示阿片系统在各种神经过程中的具体作用,比如揭示学习作用、记忆作用、情绪调节作用等。
其二,能用于疼痛研究。
在疼痛调节中,阿片系统扮演着关键角色。因此,本次探针有望用于研究急性疼痛状态下和慢性疼痛状态下的阿片肽释放模式,从而助力于开发更加有效的疼痛管理策略。
其三,能用于成瘾机制研究。
通过实时监测阿片肽在奖赏回路中的活动,或能更好地理解药物成瘾的神经生物学基础,从而为开发新型治疗方法提供线索。
其四,能用于药物开发和药物筛选。
即本次探针或可被用于高通量筛选,以帮助识别新型阿片受体调节剂,从而助力开发更安全、更有效的止痛药物。
其五,能用于情绪障碍研究。
鉴于阿片系统与情绪调节的密切关系,本次探针有望被用于研究抑郁症、焦虑症等情绪障碍的神经机制。
其六,能用于神经影像学应用。
当把这些探针加以改造,则有望用于非侵入性脑成像技术,进而用于观察人类大脑的阿片系统活动。
其七,能用于开发神经调控技术。
结合光遗传学技术或化学遗传学技术,这些探针有望帮助开发更加精确的神经调控技术,以用于治疗与阿片系统相关的疾病。
其八,能用于行为神经科学研究。
即用于研究阿片系统在复杂社会行为、决策制定等高级认知功能中的作用。
其九,能用于预防药物滥用。
通过深入了解阿片系统的功能,有助于开发更有效的药物滥用预防策略和教育方法。
其十,能用于个体化医疗。
通过在动物模型中研究不同个体阿片系统的反应差异,或能为个体化疼痛治疗和成瘾管理提供理论基础。
概括来说,这些潜在应用不仅有望推动神经科学基础研究的发展,还可能会对临床医学、药物开发和公共卫生政策产生重大影响。
当然,从基础研究到实际应用,还需要多年的研究和验证。
而在未来:
首先,将提高现有探针的性能。
即改善已有神经肽探针的特异性、灵敏度、动态范围和动力学特性。
这可能会涉及到更复杂的蛋白质工程策略,比如 AI 辅助的定向进化、结构生物学指导的理性设计等。
其次,将开发针对更多神经肽的荧光探针。
即把已有经验扩展到其他的神经肽系统、神经递质和神经调质之中。
再次,将已有探针与其他成像技术相结合。
例如,将神经肽探针与超分辨率显微技术或微型化的双光子显微镜结合,有望让人们在亚细胞水平、或在自由活动动物中,观察神经肽的释放动态。
同时,在多色成像技术的帮助之下,人们或能同时观察多种神经肽或神经递质的动态,从而能够揭示它们之间的相互作用。
最后,这些探针的应用不仅限于基础研究,还有潜力延伸到药物开发领域,即用于开发高通量筛选平台,从而助力发现新的神经精神药物。
对于神经肽探针来说,它也将继续推动神经科学研究朝着更高时空分辨率、更广泛分子多样性、以及更复杂行为的范式方向发展,为理解大脑功能和开发新型治疗策略提供支持。

参考资料:
1.Dong, C., Gowrishankar, R., Jin, Y.et al. Unlocking opioid neuropeptide dynamics with genetically encoded biosensors. Nat Neurosci (2024). https://doi.org/10.1038/s41593-024-01697-1
运营/排版:何晨龙
*博客内容为网友个人发布,仅代表博主个人观点,如有侵权请联系工作人员删除。
 图 | 董春阳(来源:董春阳)
图 | 董春阳(来源:董春阳) (来源:Nature Neuroscience)
(来源:Nature Neuroscience) (来源:Nature Neuroscience)
(来源:Nature Neuroscience) 从阿片类神经肽的“地位”说起
从阿片类神经肽的“地位”说起 (来源:Nature Neuroscience)
(来源:Nature Neuroscience) 无数次的重复、失败、优化、再重复
无数次的重复、失败、优化、再重复 (来源:Nature Neuroscience)
(来源:Nature Neuroscience) 图 | 相关论文(来源:Nature Neuroscience)
图 | 相关论文(来源:Nature Neuroscience)