近日,浙江大学相佳佳研究员和团队研制出一种三级胺氧化物修饰的聚谷氨酸-紫杉醇键合物(OPGA-PTX)。
通过调控该键合物载体的化学结构,可以优化其细胞内分布,从而起到平衡细胞内药物释放和转细胞的作用。

图 | 相佳佳(来源:相佳佳)
细胞内药物释放和转胞运的平衡问题,是此前转胞运纳米药物设计方面一个久被忽视、但又十分重要的问题。
这项工作中,他们提出一种新型的纳米药物设计策略,即在设计载体化学结构以行使各项功能时,考虑利用生物体或细胞本身的机制和通路,赋予载体智能化的特性。
也就是利用载体在不同细胞器中的分布,解决药物释放和转胞运的问题。通过此,可以为设计兼具高效转胞运作用和抗肿瘤作用的纳米药物提供新思路。
这既能解决当前纳米药物的肿瘤渗透瓶颈,让纳米药物能被递送至肿瘤细胞甚至远端细胞,同时药物也能在肿瘤细胞内得到有效释放,从而杀死肿瘤细胞。
据相佳佳介绍,这项成果是在聚谷氨酸-紫杉醇的基础上改进而来。其化学结构比较简单,而且聚氨基酸的生物相容性比较好,具有不错的转化前景。
未来,该团队将进一步拓展本次体系,在动物模型上进行试验和推进转化进程。
此外,他们也在积极拓展本次体系在其他疾病模型上的应用。比如,通过滴眼给药治疗眼部疾病,以及通过口服治疗肠道疾病等。
(来源:Advanced Materials)

胞内截留和细胞间转运的平衡难题
据介绍,纳米药物能够有效降低药物的副作用,提高一些难溶药物或易降解药物的生物利用度。
当把纳米药物经静脉注射之后,通常需要经历五个复杂的级联步骤(CAPIR):
在全身血液中的循环(Circulation);
逐渐蓄积到肿瘤组织(Accumulation);
渗透到无血管的肿瘤组织和远端肿瘤细胞(Penetration);
随后被细胞内化(Internalization);
最后释放药物杀死肿瘤细胞(Release)。
纳米药物的整体递送效率,主要取决于这五个步骤。但是,实体瘤本身情况十分复杂:其肿瘤微环境中的细胞外基质十分致密、血管分布混乱,肿瘤细胞密集堆积、间质流体压力高。
这些因素导致肿瘤渗透成为纳米药物难以克服的瓶颈,也是当前纳米药物临床疗效低的主要原因之一。
该课题组在 2019 年首次提出,利用细胞内在的转胞运作用来跨细胞递送纳米药物,以绕开肿瘤组织致密的细胞外基质,并证明这是一种能克服实体瘤渗透屏障和实现肿瘤深层渗透的有效手段。
前期研究发现,肿瘤特异性酶响应的电荷反转聚合物以及三级胺氧化物聚合物载体,能够有效促进纳米药物的肿瘤渗透效果。
但是,目前关于载体诱导细胞转胞运作用的研究,主要集中在提升转运性能,以让其在被细胞摄取之后,尽可能地被运至高尔基体或内质网等具有外泌功能的细胞器。
然而,肿瘤细胞需要截留部分纳米药物、或截留部分释放的药物,以便在完成转胞运之后,诱导肿瘤细胞死亡。
因此,如何实现药物胞内截留和细胞间转运之间的平衡,从而获得药物释放和肿瘤渗透之间的协调,进而使肿瘤治疗效果达到最佳,仍然是一项挑战。
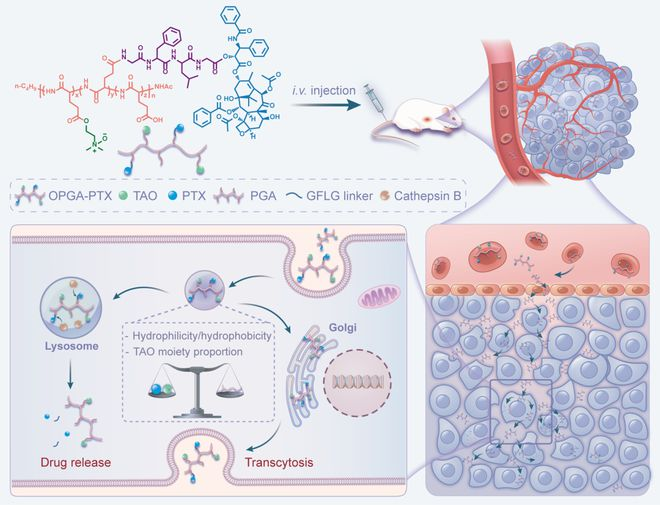
基于此,该团队设计了这种新型的聚谷氨酸-紫杉醇键合物(OPGA-PTX),其具有不同的亲疏水比和三级胺氧化物含量,并以组织蛋白酶 B 响应的多肽序列作为药物连接子。
(来源:Advanced Materials)

能在几乎不影响小鼠体重情况下显著抑制肿瘤生长
事实上,本项研究的初版思路和终版思路存在很大差别。
此前,聚谷氨酸-紫杉醇键合物已经进入过临床研究,但是最终仍以失败告终。该团队分析其中一个原因是药物在肿瘤的富集和渗透不佳所导致的。
因此,他们想把课题组之前开发的一种三级胺氧化物,修饰到聚谷氨酸-紫杉醇键合物上,以增强它的肿瘤渗透性能。
然而,他们发现所设计的药物键合物,被细胞内吞之后不仅会分布在高尔基体中,在溶酶体中也有大量分布,这与设计初衷是相悖的。
而在该团队的前期工作中,所设计的具有转胞运作用的聚合物,往往在高尔基体中有着较高的分布,而在溶酶体中则呈现出非常少的分布。
因此,他们意识到上述现象很可能是由于键合物的结构导致的。也就是说,载体亲疏水性以及三级胺氧化物的修饰比例,有可能是主要的影响因素。
于是,他们开始转换思路:能否通过优化聚合物的结构,来调控纳米药物在高尔基体和溶酶体中的分布?
之所以这样设想,是基于:高尔基体与转胞运作用密切相关,而溶酶体则是发挥胞内降解作用的重要细胞器。
当纳米药物并被细胞内吞之后,部分能转运至高尔基体,从而发挥转胞运作用;同时部分纳米药物可以被溶酶体截留,响应组织蛋白酶 B 进而释放活性药物,最终杀死顽固的肿瘤细胞。
基于此,该团队通过调节键合物的亲疏水比例和三级胺氮氧基团含量,来优化其在细胞内的分布。
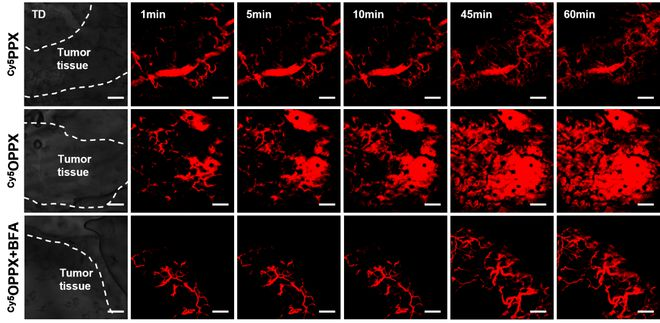
细胞实验结果表明:亲疏水比例和三级胺氮氧基团含量,对键合物的内吞、亚细胞分布和转胞运作用产生决定性影响。
他们由此筛选出最符合预期的紫杉醇键合物:它可以被细胞快速内吞,在溶酶体和高尔基体中具有较为平衡的分布,并能发挥快速转胞运和肿瘤渗透能力。
对于筛选出来的紫杉醇键合物,课题组在动物水平上考察其是否具有良好的血液循环能力、肿瘤血管外渗和肿瘤渗透能力。
结果发现在动物实验中,所筛选的紫杉醇键合物的确展现出优异的能力,这为进一步开展体内抗肿瘤实验打下了基础。
而在体内抑瘤活性实验中,相比对照组,目标紫杉醇键合物也展现出更好的抗肿瘤效果,能在几乎不影响小鼠体重的情况下显著抑制肿瘤生长。
这表明本次设计的紫杉醇键合物,具有良好的生物安全性和抑瘤活性。
此外,相佳佳表示:“本项研究的绝大部分工作由课题组的一名硕士生和一名博士生合作完成,分别负责生物学表征和聚合物载体合成。”
让他印象最深刻的是这位硕士生,这名女生几乎从零开始入门,独立完成了所有细胞实验和动物实验的验证工作。
刚加入实验室的时候,她几乎不懂细胞也非常害怕小鼠,高分子载体设计的知识也比较薄弱。
“期间,她经历了许多次的实验失败再重来,也经历了多次自我信心的不断重建。”相佳佳说。
当发现本次聚合物和课题组此前设计的转胞运触发型载体,在溶酶体和高尔基体中存在巨大分布差异时,这名女生非常崩溃,一度考虑是否放弃课题,毕竟当时还面临着毕业的压力。
“好在她坚持下来了,那段时间我们不断地讨论和尝试,逐渐提出最终的研究思路,即通过优化聚合物的化学结构,来调节聚合物在高尔基体和溶酶体中的分布,以便平衡纳米药物转胞运和胞内释放。”相佳佳说。
如今,这名女生的细胞实验技能和动物实验技能也愈加娴熟,克服了对小鼠的恐惧,科研水平也得到质的提升,目前正在香港科技大学攻读博士学位。
另外,相关论文也于近期以《调节细胞内动力学以优化细胞内释放和转胞吞平衡》(Modulating Intracellular Dynamics for Optimized Intracellular Release and Transcytosis Equilibrium)为题发在 Advanced Materials[1]。
袁桂萍和李明辉是第一作者,相佳佳和浙江大学申有青教授担任共同通讯作者。

图 | 相关论文(来源:Advanced Materials)
不过,研究中他们也发现该键合物依旧存在一些不足,因此后续要继续优化结构,在大动物模型上进行验证。同时,还得考虑相关药物的放大生产,尽可能地推进临床转化。
另外,相佳佳表示:“AI for Material Design 一定是未来的趋势,我们课题组当然也不会错过这样一个机遇,要抓紧上船,目前也正在开展这方面的工作。”

参考资料:
1.Yuan, G., Li, M., Zhang, Y., Dong, Q., Shao, S., Zhou, Z., ... & Shen, Y. (2024). Modulating Intracellular Dynamics for Optimized Intracellular Release and Transcytosis Equilibrium. Advanced Materials, 2400425.
*博客内容为网友个人发布,仅代表博主个人观点,如有侵权请联系工作人员删除。