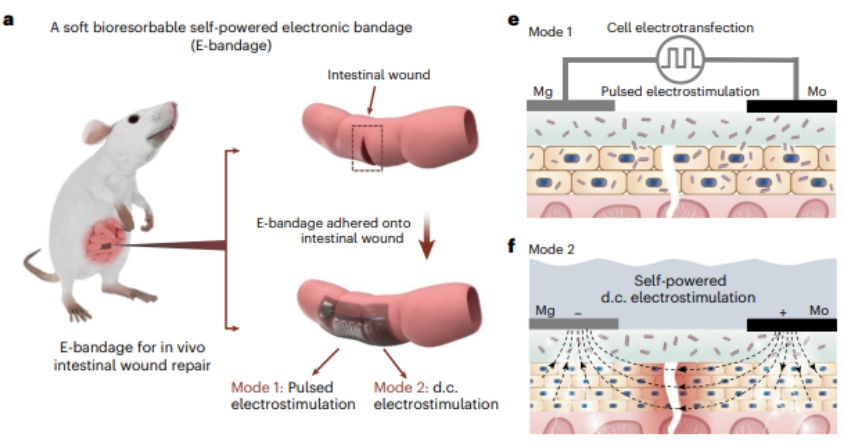
近日,北京航空航天大学常凌乾团队,设计了一种自供电柔性电刺激微电极系统(称为“电子绷带”)。
其具备全植入式和可生物降解的特点,大约可以在体内存在数周时间,实现其生物学功能(即促进肠道损伤愈合)后全部降解。

图 | 常凌乾(来源:常凌乾)
当将电子绷带用于小鼠肠道损伤模型之中,脉冲电刺激可以将生长因子(EGF,Epidermal Growth Factor)基因,高效地表达到肠道上皮细胞中。
同时,直流电刺激可以持续地刺激细胞,将细胞内产生的大量 EGF 蛋白分泌至细胞外。
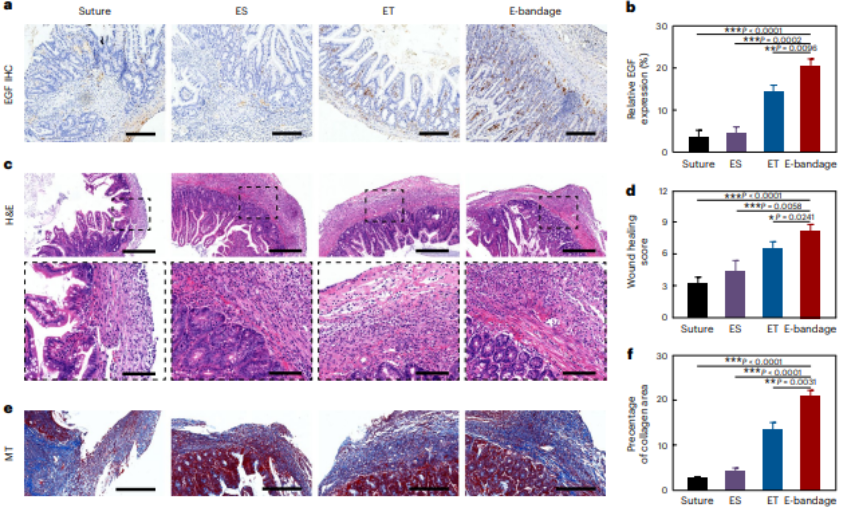
在这种协同作用之下,小鼠肠道在电子绷带植入 14 天之内完成良好愈合。与传统手术缝合相比,增生和梗阻等术后并发症的概率显著减少,并且修复之后的小鼠肠道组织,在粘膜连续性、肌肉连续性和肉芽组织形成上表现良好。
当对小鼠粪便进行菌群测序分析之后,电子绷带显示出较高的益生菌相对丰度和活力水平。
(来源:Nature Electronics)
在整个生物降解期之内,被植入电子绷带的健康小鼠血清中的 C 反应蛋白和白细胞介素-2(IL-2),相比未植入电子绷带的健康小鼠,没有出现明显差异。
同时,植入小鼠的心脏、肝脏、脾脏、肺、肾脏没有发现明显的炎症反应,这证明电子绷带具备良好的生物兼容性。
此外,电子绷带使用镁和钼的微电极对,且金属含量均远低于每日推荐的膳食摄入量,不会对生物体造成伤害。
同时,这两种材料都具备可生物降解的特点,是理想的植入式器件的电极材料。
总的来说,凭借这款电子绷带的双电刺激策略,为加速伤口愈合提供了一条富有潜力的途径。
虽然本次工作仅仅展示了小鼠肠道伤口的愈合案例。但也可以用于促进其他器官和组织的伤口愈合,包括神经系统、皮肤和肌肉等。
(来源:Nature Electronics)

据了解,肠道的结构比较独特,而且微环境比较复杂。因此,其伤口愈合是一项具有挑战性的医学问题。
缝合手术是常用的传统治疗方案,但可能会导致恢复时间长、以及肠道增生和梗阻等术后并发症。手术钉和压迫吻合环,尽管可以作为替代方案,但也可能会导致更多的组织损伤。
伤口要想成功愈合,就需要促进关键细胞的增殖。而携带干细胞和愈合因子的组织密封剂或水凝胶,可能具备加速愈合的能力。
然而,组织密封剂或水凝胶不能主动调节细胞内基因表达、胞外分泌和细胞外微环境中的增殖。
这种情况之下,无法加速伤口部位所必需的细胞增殖,自然也就无法有效地干预伤口愈合过程。
电刺激,此前已被用于促进浅表组织和器官的愈合。不过,一些现有的技术挑战阻碍了临床应用。
比如说,对于电刺激这种手段来说,必须使用一个可植入的可控电源,来按需提供电刺激。
随后,让可控电源在生物体内完成自降解。这种方法尽管无需二次手术摘除,但是依然未能得到实现。
而在本次研究伊始,课题组在细胞实验中进行了一系列脉冲电刺激的探究,通过此他们发现用于细胞增殖的 EGF 基因,不仅具备较高的递送效率,并且可以很好的转率和翻译。
但是,这样的增殖效率似乎并不能达到理想效果。考虑到细胞增殖的机理在于生长因子蛋白必须要被分泌至细胞外,与邻近细胞表面受体结合才能起到最终的作用。
因此,他们推测通过单纯的脉冲电刺激来提高胞内 EGF 含量,并不能明显地提高胞吐的能力。
于是,他们开始研究电刺激的作用时间长短,是否能够影响到细胞的胞吐行为。通过延长脉冲电刺激的时间,该团队发现细胞的增殖速率果然得到了进一步提高。
但这显然是不现实的,因为手术窗口期是有限的,显然无法通过脉冲电刺激实现这一功能。
鉴于此,他们打算寻找一种既可以持续输出电刺激、且不管强度多大都可以实现自驱动的电刺激,同时还得适应需要完全植入生物体内的应用场景。
后来,他们发现基于原电池原理的生物可吸收金属材料,或许能够实现这一需求。通过测试和筛选,课题组锁定了镁和钼这两种金属。
与此同时,以这两种金属为导向的微电极对,还可以作为脉冲电转染的正负极。
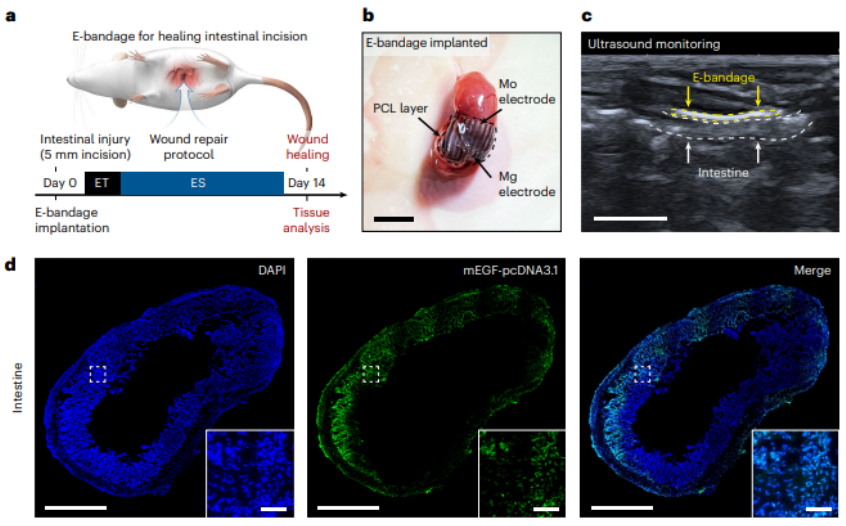
接下来,他们通过在小鼠肠道损伤模型中,初步验证了该系统的可行性。
经过一段时间的试错,课题组发现相比临床手术缝合线的方式,在术后发生梗阻和增生等方面,这种双电刺激合璧的系统具有明显的优势。
并且,相比只是单一种电刺激的情况下,其愈合疗效也非常出色。
(来源:Nature Electronics)

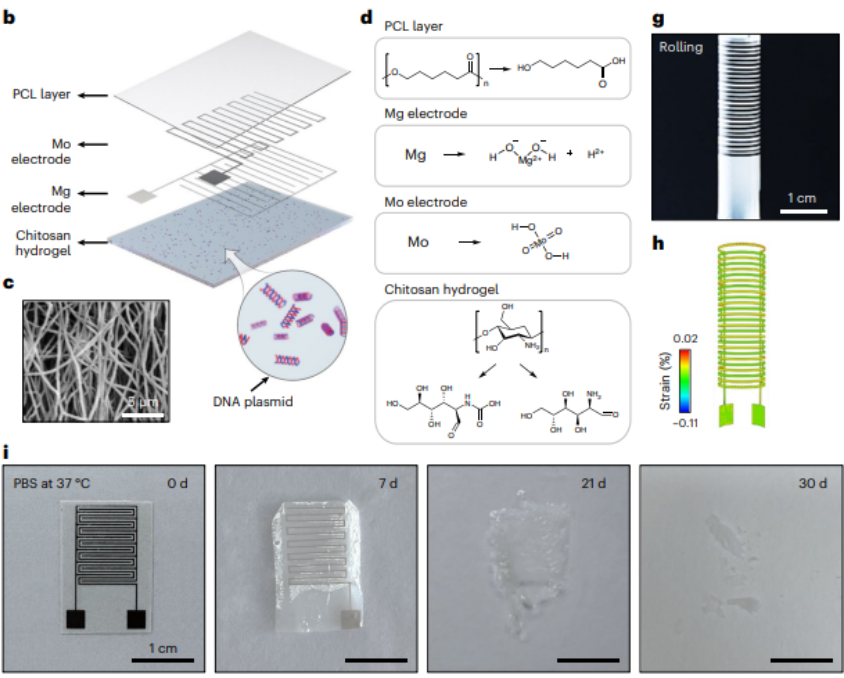
据介绍,电子绷带由三层结构组成,其中的所有材料都具有生物可降解性:
第一层是多孔聚己内酯薄膜,也是本次系统的基底层。通过静电纺丝工艺,上述薄膜可以形成纤维网络。
第一层主要有两大作用:
其一,可以支撑镁/钼电极沉积在薄膜表面;其二,可以作为电子绷带的封装,延长器件的使用寿命。
第二层是镁和钼形成的微叉指电极对。其中,电极层通过阴影掩模磁控,溅射在聚己内酯基底之上。
第二层也主要有两大作用:
其一,可以通过术中施加脉冲电刺激,从而充当正负电极对的作用,进而用于一次性的基因递送,以便将含有 EGF 片段的 DNA 质粒,递送到肠道上皮细胞中,促进细胞对外源 EGF 基因进行有效转录和翻译。
其二,镁/钼两种金属的电极在体液环境中,可以形成一个原电池,从而持续地向组织部位释放大约 1V 的直流电刺激。
第三层是壳聚糖水凝胶层,能通过匀胶仪旋涂在微电极的另一侧。
第三层的两大作用如下:
其一,壳聚糖水凝胶可以直接接触肠道组织,其本身的粘性可以将电子绷带牢固地粘附在肠道伤口位置。
其二,水凝胶的三维多孔状结构,可以吸附和储存 EGF 基因溶液,以便用于脉冲电转染。
而采用双电模态刺激促进肠道损伤修复的机理,则可分为两个方面:
一方面,通过脉冲电场,将含有 EGF 基因的质粒递送到细胞内部,促使细胞进行转录和翻译,从而增加 EGF 的蛋白表达量。
对于伤口愈合来说,只有 EGF 蛋白这样的愈合因子分泌到胞外,与邻近细胞表面受体结合,才能起到愈合作用。
另一方面,镁/钼电极在体液环境中所形成的原电池,可以持续地释放直流电场,当对损伤位置的细胞进行电刺激时,就能促使细胞离子通道打开,从而增强蛋白质的胞吐作用。
进而将大量的 EGF 源源不断地分泌到细胞之外,最终达到双重电刺激的协同作用,借此促进上皮细胞的增殖,进而加速组织伤口的愈合。
相比缝合、药物联用、以及使用单电模态(脉冲或直流)刺激的电子绷带等方法,这种基于双电刺激协同作用的电子绷带和上述三者存在以下不同之处:
首先,对于双电刺激电子绷带和基于缝合加药物的治疗来说,应该使用含有 EGF 蛋白的敷料一类药物。
但是,由于 EGF 蛋白的半衰期非常短,无法有效地避免干预伤口愈合的过程。因此,促进伤口愈合的程度会受到很大限制,导致无法达到理想的愈合结果。
其次,对于双电刺激电子绷带和单次电刺激电子绷带的区别来说,主要需要分为两种情况。
第一种情况,脉冲电刺激尽管可以提升细胞内 EGF 蛋白的总量,但是由于电刺激作用时间非常短暂(几十秒),因此无法将足够的 EGF 蛋白排向胞外。这样一来,就会导致细胞增殖结果不明显,伤口愈合情况自然也就不理想。
第二种情况,直流电刺激的确可以促进细胞发生胞吐行为。但是,由于细胞自身所产生的 EGF 蛋白非常有限,同样也会导致细胞外能用于增殖的 EGF 蛋白总量较少,最终依旧无法实现细胞增殖,进而无法有效地促进伤口修复。
而基于双电刺激的电子绷带,巧妙地弥补了以上缺陷,让局部源源不断地产生大量 EGF 蛋白,发挥促进愈合的作用。
相比传统方案,这种提高自体分泌 EGF 的策略,不仅能缩短愈合时间,还能减少增生、梗阻等并发症,并能提高肠道微环境健康。
(来源:Nature Electronics)

有时,一项成功的科研常会伴随着酸甜苦辣和崎岖坎坷。
论文一作(吴晗,北航三年级博士生)对该研究感慨颇多:“2021 年冬天,因为要对电子绷带植入小鼠体内后做超声检测,我和王玉琼师姐顾不上吃晚饭,抱着刚麻醉后的小鼠。”
北京的冬天很冷,王玉琼将老鼠捂在怀里,生怕低温老鼠去世。
吴晗继续说道:“这里要特别感谢王思奇哥(王玉琼师姐老公),开车送我们去做小动物超声影像,暖风开到最大,一路颤颤巍巍。”
很幸运的是他们拍成了,不幸的是就在回实验室的路上,小老鼠没能抵抗住寒冷的天气壮烈牺牲了。“师姐说,这或许就是科研人的艰辛和不易,一切都得重头再来喽。”论文一作表示。
当然,最终的结果是美好的。相关论文以《通过柔软且可生物降解的电子绷带的双重电刺激加速肠道伤口愈合》(Accelerated intestinal wound healing via dual electrostimulation from a soft and biodegradable electronic bandage)为题发在 Nature Electronics(IF 34.3)。

图 | 相关论文(来源:Nature Electronics)
北航的吴晗博士生、王玉琼博士、李虎博士(现为香港城市大学博士后)是共同一作,北航的常凌乾教授和助理教授王柳、以及美国宾夕法尼亚州立大学余存江教授担任共同通讯作者[1]。

图 | 从左到右:常凌乾、吴晗、王玉琼、李虎(来源:资料图)
和药物上市相似的是,假如自供电电子绷带要进行人体实验,就得开展临床试验。
鉴于电子绷带属于医疗器械,因此要遵从国家药品监督管理局组织制定的《医疗器械动物试验研究注册审查指导原则》和 GB/T 16886 一系列标准。
并根据医疗器械生物学评价相关的技术文件,开展进一步的大型动物实验,比如猪和灵长类动物的实验。
基于目前的研究,下一步他们计划在现有芯片系统基础之上,针对修复过程中的伤口进行实时监测,并希望能做到随时诊断、及时治疗的一体化集成系统。
在本次研究之中,他们发现虽然自供电电子绷带有很好的促愈合疗效,但是这种结果也只能在术后特定时间去观察最终的治疗效果。



*博客内容为网友个人发布,仅代表博主个人观点,如有侵权请联系工作人员删除。