专访蔡孟浩丨华东理工团队历时八年三次迭代改造毕赤酵母,开发即插即用通用型平台,有望产业化应用
深科技 | 2022-03-12 21:03:45 阅读:634
 发布文章
发布文章
生物制****和制造行业需要高水平和可控的基因表达来生产蛋白质。如何设计和开发兼具高表达强度和灵活调控特性的新型表达系统,是生物工程和合成生物技术所面临的关键问题和重要目标之一。
酵母作为人们熟知的真核微生物,在食****方面的应用已有悠久的历史,在现代蛋白生产和生物合成方面也有非常广泛的应用。甲基营养型酵母 —— 巴斯德毕赤酵母,因其生长密度高、蛋白表达强、遗传稳定好和糖基化修饰温和等优点,在学术研究和工业生产中均展现了很好的应用效果,已成为重组蛋白表达的优选底盘细胞。
然而,毕赤酵母作为一种非模式生物体,其强启动子种类和数量有限,且多基于甲醇诱导特性,在工业设施安全和食品应用安全方面存在一定的风险。同时,这些启动子的转录调控模式单一,多受发酵碳源的严格阻遏,使大宗蛋白或化学品生产中的底物谱受限,很大程度上限制了其在更广阔场景下的应用潜力。
近日,华东理工大学生物工程学院蔡孟浩课题组在新型酵母表达设计方面取得重要进展,开发了可响应用户自定义信号的高效毕赤酵母蛋白表达平台,相关成果已在线发表于 Science Advances 上。
可响应用户自定义信号:
只需找到已报道的、或用户自定义筛选条件通过组学筛选的低强度启动子,即可接入 SynPic-X 平台(高效表达的毕赤酵母平台)实现响应用户自定义条件的高效表达。理论上,通过目前的测序和组学技术,较易筛选获得低强度启动子。借此机会,生辉 SynBio 邀请到了蔡孟浩来与我们分享他的研究进展。
 图丨蔡孟浩(来源:受访者提供)蔡孟浩本科毕业于华东理工大学理工优秀生部,随后保研到华东理工大学生物工程学院张元兴教授和周祥山教授课题组进行硕博连读,期间还前往英国布里斯托大学化学院 Russell J. Cox 教授课题组进行联合培养,开展真菌聚酮****物的组合生物合成及发酵工程研究。现为华东理工大学生物工程学院副教授、博士生导师、生物反应器工程国家重点实验室 PI,获得国家高层次特殊支持计划青年拔尖人才、上海市青年科技启明星计划资助。
图丨蔡孟浩(来源:受访者提供)蔡孟浩本科毕业于华东理工大学理工优秀生部,随后保研到华东理工大学生物工程学院张元兴教授和周祥山教授课题组进行硕博连读,期间还前往英国布里斯托大学化学院 Russell J. Cox 教授课题组进行联合培养,开展真菌聚酮****物的组合生物合成及发酵工程研究。现为华东理工大学生物工程学院副教授、博士生导师、生物反应器工程国家重点实验室 PI,获得国家高层次特殊支持计划青年拔尖人才、上海市青年科技启明星计划资助。
“尽管组合生物合成是合成生物学的方向之一,但其化学学科属性更强,因此上学期间我对合成生物学并不了解。直到 2014 年参加了冷泉港亚洲合成生物学国际会议,在聆听麻省理工学院 Christopher Voigt 教授的 “Programming cells as a placeholder” 主题演讲后,如醍醐灌顶,决定融合以往的科研经历,开设合成生物学研究方向。”
目前,其主要研究方向聚焦毕赤酵母新型细胞工厂创制与应用,包括特色酵母元器件设计、新型酵母底盘开发、重组蛋白表达及天然产物合成应用。
 即插即用的新型酵母表达平台
即插即用的新型酵母表达平台
“毕赤酵母作为底盘细胞,在工业中广泛用于蛋白表达,但表达过程中需要一个强诱导型启动子。这个菌常用的 PAOX1(醇氧化酶基因)启动子虽强度较强,但严谨性也高,有且只有甲醇存在的条件下,才能诱导开启,若混杂其他碳源,就会产生阻遏而无法表达,因此使用场景相对较窄,产品体量较小。” 蔡孟浩说道。
随着工业生物技术体系快速发展,未来生物制造的体系需做到很大规模。但毕赤酵母仅能利用甲醇进行高效诱导表达的特性存在三方面的问题。其一,甲醇具有毒性,大规模生物制造时考虑成本问题产品往往无法做到很精细的纯化,比如若用于制造食品,则会给人体带来伤害;其二,甲醇易燃易爆,大规模生物制造使用时的安全性仍需评估;其三,大规模应用需考虑成本问题,低成本意味着工业发酵时复合原料底物可能会混有多种阻遏碳源,这会阻遏毕赤酵母对甲醇的代谢利用,并且与其只能在甲醇存在的条件下诱导表达相矛盾。
“基于这三方面问题,我们希望毕赤酵母作为底盘细胞既能保持它的强表达优势,同时也具有较强鲁棒性。”因此,蔡孟浩课题组历时八年对毕赤酵母进行三代改造,使其能突破单一甲醇诱导的高效表达蛋白。
他介绍道,第一代体系主要解决的是毕赤酵母甲醇调控过于严谨问题,通过解析诱导甲醇的转录调控机制,找到一个关键的转录激活因子,发现该转录因子与其他几个转录因子在响应甲醇信号过程中存在级联传递机制。基于此机制,对毕赤酵母进行了代谢工程层面的改造。简单改造后能够让毕赤酵母实现部分甲醇诱导的碳源脱阻遏,可以用葡萄糖和甘油产生类似诱导的效应,但表达能力没有甲醇强。
为解决此问题,蔡孟浩课题组利用合成生物学技术设计了简单遗传线路,最核心的是通过人工设计的方式让激活因子更好地结合启动子,激发其表达,改造之后的第二代体系表达强度得到提升。但由于转录放大效应,渗漏表达也提高了。在工业生产中,毕赤酵母生长阶段尽量不期望出现产物的合成,否则会给细胞代谢带来较重负担,最终影响生物量和产物量。
因此第三代要解决的是进一步去除渗漏表达问题,同时保持毕赤酵母很高的表达强度。蔡孟浩课题组通过分析毕赤酵母天然转录调控网络并重塑转录调控机器,设计了一套具有高强度表达能力的转录信号增益器件 iTSAD,实现输入信号的高效放大,达到商业化毕赤酵母 PAOX1 表达强度的 5.2 倍。
同时,针对其介导的渗漏表达水平较高的问题,基于 CRISPR 基因调控技术,设计 CRISPRi 阻遏器件以解决高渗漏表达问题,并设计 CRISPRa 激活器件以抵消 CRISPRi 的高限表达压制,以此可响应灵活、低强度输入信号而协同控制 iTSAD 器件,有效解决高渗漏表达问题,并通过对引导 RNA 组合的理性设计和筛选验证,实现完整系统的高强度表达输出。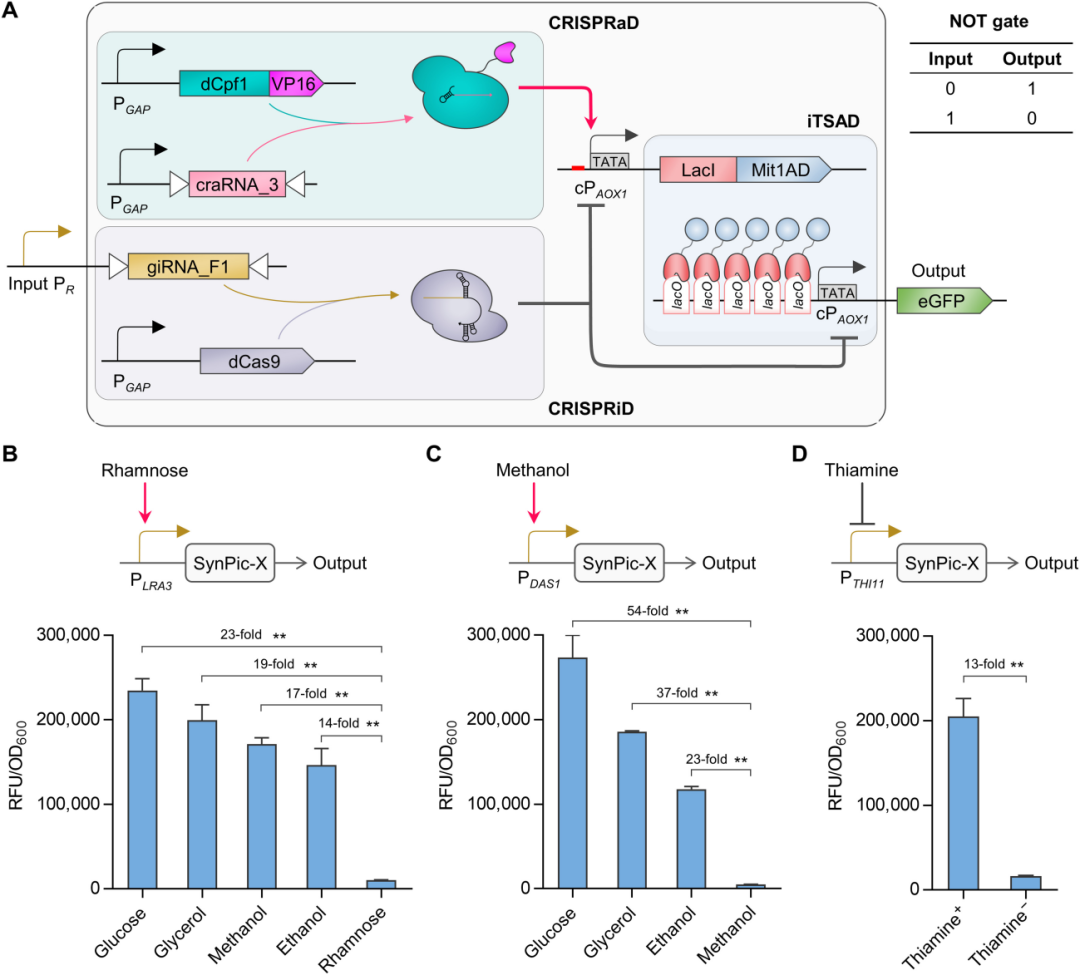 图 A丨响应自定义信号的合成型毕赤酵母平台(SynPic-X)的开发由此,最终开发成功具有高强度、低渗漏、可编程特性的合成型毕赤酵母表达平台 SynPic-X。“这是一个通用型的高强度、可编程平台,通过简单地 “插拔” 已知的或简单组学筛选的单一低输入启动子即可实现响应用户自定义信号的高水平蛋白表达和严谨调控。”
图 A丨响应自定义信号的合成型毕赤酵母平台(SynPic-X)的开发由此,最终开发成功具有高强度、低渗漏、可编程特性的合成型毕赤酵母表达平台 SynPic-X。“这是一个通用型的高强度、可编程平台,通过简单地 “插拔” 已知的或简单组学筛选的单一低输入启动子即可实现响应用户自定义信号的高水平蛋白表达和严谨调控。”
 有望产业化应用
有望产业化应用
目前,针对该表达平台,蔡孟浩团队输入了不同类型的启动子进行检验,分别构建了鼠李糖信号响应系统 SynPic-R、甲醇信号响应系统 SynPic-M 和硫胺素信号响应系统 SynPic-T,均可实现对特定信号的严谨调控和高效响应,在激活状态下分别达到商业化毕赤酵母 PAOX1 表达强度的 3.8 倍、4.4 倍和 3.3 倍。
为了测试 SynPic-X 平台的实际应用价值和潜力,蔡孟浩团队还选取鼠李糖信号响应系统 SynPic-R 用于驱动工业淀粉酶的表达,在 3 升反应器水平得到了与商业化毕赤酵母 PAOX1 甲醇诱导表达相当的产量,且生产工艺控制更为绿色、安全、简便,展现了良好的工业应用前景。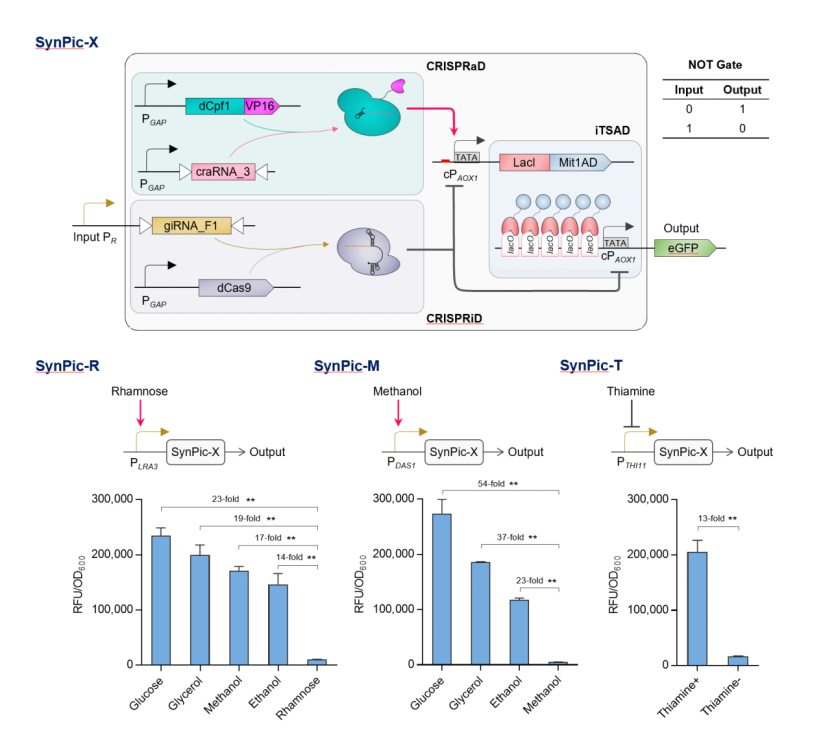 (来源:受访者)“下一步我们将继续升级毕赤酵母细胞工厂,主要包括两个方面,其一是设计开发多底物协同利用型底盘,以满足大规模蛋白及天然产物制造的低成本、高鲁棒性需求;其二是设计开发翻译后修饰定制型底盘,以满足动植物源****用活性分子的高活性和高效生物合成需求。”
(来源:受访者)“下一步我们将继续升级毕赤酵母细胞工厂,主要包括两个方面,其一是设计开发多底物协同利用型底盘,以满足大规模蛋白及天然产物制造的低成本、高鲁棒性需求;其二是设计开发翻译后修饰定制型底盘,以满足动植物源****用活性分子的高活性和高效生物合成需求。”
除了毕赤酵母发酵平台,蔡孟浩团队还建有丝状真菌和大肠杆菌发酵平台体系,其中,毕赤酵母发酵平台主要针对重组蛋白及小分子****物、新型食品替代蛋白;丝状真菌发酵平台主要针对天然****物及色素;大肠杆菌发酵平台主要针对特殊功能酶等。
蔡孟浩说道,“我们前期开发的毕赤酵母表达系统及蛋白****物表达应用已经实现企业转让,同时在新型替代蛋白、抗衰****物开发方面也在与企业开展密切的研发合作,有望在 1~2 年内实现产业化应用。”
采访最后,蔡孟浩老师也向我们分享了他的科研经验和培养学生的心得体会,他认为研究要 “博观约取”,广泛汲取新学术思想和技术方法,但也要以应用出口为导向进行谨慎选取和融合,基于此的 “机制 - 重构 - 应用” 研究思路和目标会更加明确,适合应用基础研究体系。
在培养学生方面,要引导(建立思路)、鼓励(提升信心)、敦促(增强动力)相结合,这对于学生的独立和快速成长非常重要。参考资料:https://www.science.org/doi/10.1126/sciadv.abl5166
*博客内容为网友个人发布,仅代表博主个人观点,如有侵权请联系工作人员删除。
 图丨蔡孟浩(来源:受访者提供)
图丨蔡孟浩(来源:受访者提供) 即插即用的新型酵母表达平台
即插即用的新型酵母表达平台 图 A丨响应自定义信号的合成型毕赤酵母平台(SynPic-X)的开发
图 A丨响应自定义信号的合成型毕赤酵母平台(SynPic-X)的开发 有望产业化应用
有望产业化应用 (来源:受访者)
(来源:受访者)